Биолюминесцентные системы на основе люциферина светлячков
Биолюминесце́нтные систе́мы на осно́ве люцифери́на светлячко́в, набор белков и небольших органических молекул, позволяющих некоторым видам насекомых испускать свет. Ключевыми компонентами являются общий для всех систем люциферин (D-люциферин), аденозинтрифосфат (АТФ) и различные ферменты люциферазы. D-люциферин в своих биолюминесцентных системах используют представители семейств светлячков (Lampyridae), жуков-щелкунов (Elateroidae) и железнодорожных червей (Phengodidae). Люциферазы различных семейств различаются по структуре и биохимическим свойствам, однако механизм реакции окисления люциферина у всех одинаковый. Реакция окисления D-люциферина двухстадийная и идёт через образование его аденилата. Биолюминесцентные системы на основе люциферина светлячков хорошо изучены и нашли широкое применение в биотехнологии и медицинских исследованиях.
Свечение (биолюминесценция) насекомых было известно человечеству с древнейших времён, и на протяжении всей его истории предпринимались попытки понять суть этого явления, однако настоящее изучение биолюминесцентных систем на основе люциферина светлячков началось около сотни лет назад и продолжается до сих пор.
Виды насекомых, обладающие биолюминесценцией, присутствуют в четырёх отрядах: полужесткокрылые (Hemiptera), жесткокрылые (жуки, Coleoptera), двукрылые (Diptera) и ногохвостки (Collembola). Бо́льшая часть биохимических и молекулярно-биологических исследований механизмов свечения насекомых была проведена в основном на представителях отрядов жесткокрылых и двукрылых. Представители жесткокрылых (светлячки, жуки-щелкуны и железнодорожные черви) используют в своих биолюминесцентных системах один и тот же D-люциферин. Согласно имеющимся данным, биолюминесцентные системы полужесткокрылых, ногохвосток и двукрылых насекомых значительно отличаются от таковых у жесткокрылых.
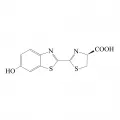
D-люциферин
D-люциферин [(S)-2-(6’-гидрокси-2’-бензотиазолил))тиазолин-4-карбоновая кислота] представляет собой относительно стабильное соединение по сравнению с другими известными люциферинами. Активный люциферин является именно D-изомером, тогда как L-изомер, хоть и вступает в реакцию с люциферазой, фактически является её конкурентным ингибитором (Lembert. 1996).
Люциферин-люциферазная реакция
Реакция окисления D-люциферина двухстадийная. Сначала происходит аденилирование люциферина, а затем окисление аденилата люциферина. Аденилирование люциферина требует присутствия АТФ и ионов Mg2+ и проходит аналогично реакциям, катализируемым аминоацил-тРНК-синтетазами и ацетил-КоА-лигазами (Wood. 1995; McElroy. 1967). Оксилюциферин светлячков способен к кето-енольной таутомерии. Преобладание кето-формы смещает цвет испускаемого света в красную область, а енольная форма сдвигает спектр излучения в коротковолновую область, делая цвет жёлто-зелёным. Соотношение изоформ зависит от рН среды.
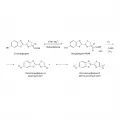 Механизм люциферин-люциферазной реакции с участием D-люциферина. Биолюминесцентная система светлячков
Механизм люциферин-люциферазной реакции с участием D-люциферина. Биолюминесцентная система светлячков
У самцов и самок разных родов светлячков имеются значительные различия в морфологии. У некоторых из них и самец, и самка крылаты и способны испускать свет.  Светлячок.Они используют световые сигналы, чтобы найти друг друга. У других самки светятся, а самцы нет, а некоторые виды вообще не способны излучать свет. У родов Lucidota и Pyropyga светятся только личинки. У большинства видов светятся яйца. Длительность и частота вспышек у самок видоспецифичны, что позволяет находить самцов своего вида в местах, где обитают несколько различных видов светлячков.
Светлячок.Они используют световые сигналы, чтобы найти друг друга. У других самки светятся, а самцы нет, а некоторые виды вообще не способны излучать свет. У родов Lucidota и Pyropyga светятся только личинки. У большинства видов светятся яйца. Длительность и частота вспышек у самок видоспецифичны, что позволяет находить самцов своего вида в местах, где обитают несколько различных видов светлячков.
Люциферазы светлячков
Первые частично очищенные препараты люциферазы этого типа были получены из американского светлячка Photinus pyralis (Green. 1956). Позднее удалось клонировать и экспрессировать ген люциферазы данного вида в системе in vitro трансляции (Synthesis of active firefly luciferase... 1984.) и в клетках бактерии кишечной палочки (Esherichia coli) (Cloning firefly luciferase. 1986; Cloning of firefly luciferase cDNA... 1985). Известны последовательности ДНК генов около двух десятков люцифераз разных видов светлячков.
Люциферазы светлячков – это мономерные эуглобулины с молекулярной массой около 60 кДа, которые могут димеризоваться в концентрированных растворах (Wood. 1995; Ugarova. 1989; Hannah. 1999). Степень сходства аминокислотных последовательностей люцифераз разных видов светлячков лежит в пределах 60–80 % (Viviani. 2002). Данные структурных исследований показали, что они имеют на своей поверхности два независимых друг от друга сайта связывания для АТФ и люциферина, а также отдельный сайт для связывания аденилата люциферина (Ugarova. 1989).
Применение
Биолюминесцентная система светлячка традиционно применяется для определения концентрации АТФ, которую, в свою очередь, можно использовать в различных биологических, медицинских, экологических и других исследованиях, а также в некоторых отраслях народного хозяйства. Например, измерение уровня внутриклеточного АТФ применялось в исследованиях цитотоксичности различных антигенов. Также концентрацию АТФ можно использовать для оценки уровня микробного загрязнения проб и образцов в исследованиях окружающей среды и в системе здравоохранения, для контроля качества пищевых продуктов и напитков, питьевой воды и экспресс-тестов на чувствительность к антибиотикам, для микробного мониторинга нефтяных месторождений.
Биолюминесцентная система светлячков используется для визуализации различных типов клеток и процессов: при изучении возникновения и развития раковых опухолей, в том числе для подбора препаратов для химиотерапии и визуализации опухолей у подопытных животных; при изучении и разработке способов лечения различных инфекционных заболеваний, в том числе вызванных вирусами и простейшими; иммунологических исследованиях; биоимиджинге, в том числе многоцветном.
Биолюминесцентная система жуков-щелкунов
Несколько известных родов биолюминесцентных жуков-щелкунов относятся к трибе Pyrophorini. Способностью излучать свет обладают как взрослые животные, так и личинки. У особей большинства видов имеется два «фонаря». Один светящийся орган в форме двух овальных пятен расположен на голове,  Жук рода огненосные щелкуны (Pyrophorus).он светится в темноте достаточно ярким зеленоватым светом. Второй расположен на брюшке в первом абдоминальном сегменте. Максимум эмиссии биолюминесценции пятен на голове лежит в диапазоне 525–560 нм, в то время как у органа на брюшке он смещён на 20–40 нм в длинноволновую часть спектра (Colepicolo-Neto. 1986). Одна особь жука-щелкуна может нести в себе несколько генов люцифераз. Так, из представителей вида Pyrophorus plagiophthalamus были клонированы четыре люциферазы, отличающиеся по цвету биолюминесценции, возникающей в катализируемых ими реакциях (Complementary DNA... 1989).
Жук рода огненосные щелкуны (Pyrophorus).он светится в темноте достаточно ярким зеленоватым светом. Второй расположен на брюшке в первом абдоминальном сегменте. Максимум эмиссии биолюминесценции пятен на голове лежит в диапазоне 525–560 нм, в то время как у органа на брюшке он смещён на 20–40 нм в длинноволновую часть спектра (Colepicolo-Neto. 1986). Одна особь жука-щелкуна может нести в себе несколько генов люцифераз. Так, из представителей вида Pyrophorus plagiophthalamus были клонированы четыре люциферазы, отличающиеся по цвету биолюминесценции, возникающей в катализируемых ими реакциях (Complementary DNA... 1989).
Люциферазы жуков-щелкунов
Биолюминесцентная система жука-щелкуна достаточно хорошо изучена. Найдено и клонировано несколько люцифераз из различных видов семейства Elateroidae. Люциферазы имеют молекулярную массу около 60 кДа. У особей большинства видов два светящихся органа, различающиеся не только длиной волны испускаемого ими света, но и, соответственно, содержащимися в них люциферазами. Максимум эмиссии люминесценции реакций, катализируемых люциферазами жуков-щелкунов, обычно лежит в диапазоне от 525 нм до 593 нм (Colepicolo-Neto. 1986; Biggley. 1967), но может отличаться даже у представителей одного вида, живущих в разных популяциях (A new orange emitting luciferase... 2016; Oba. 2010).
За разный цвет люминесценции светящихся органов жуков-щелкунов отвечают разные люциферазы. В 1989 г. клонированы четыре люциферазы Pyrophorus plagiophthalamus, которые различались по цвету биолюминесценции в реакции с люциферином: зелёная (λmax = 546 нм), жёлто-зелёная (λmax = 560 нм), жёлтая (λmax = 578 нм) и оранжевая (λmax = 593 нм) (Complementary DNA... 1989). Люциферазы жуков-щелкунов не имеют батохромного сдвига при понижении рН реакционной смеси, характерного для люциферазы светлячков (Viviani. 1999).
Применение
Люциферазы жуков-щелкунов достаточно активно используются в разработке различных биологических и биомедицинских методик, например при исследованиях инфекционных заболеваний. Белковые конструкции на основе люциферазы P. plagiophthalamus применяли в ряде работ с использованием вирусных инфекций для анализа по генам-репортёрам при изучении бакуловирусов, в качестве репортёров экспрессии генов у бактерий Candida albicans, при наблюдении за развитием инфекции, вызванной бактериями Listeria monocytogenes, в клеточных культурах и мышиных моделях и при исследованиях заболеваний, возбудителем которых являются простейшие, например Trypanosoma brucei. На основе биолюминесцентной системы жуков-щелкунов созданы инструменты для биоимиджинга и исследований цитотоксичности, а также различные биосенсоры.
Биолюминесцентная система железнодорожных червей (фенгодид)
Жуки семейства Phengodidae (фенгодиды), известные также как железнодорожные черви, обитают в основном в Западном полушарии.  Светящаяся личинка железнодорожного червя (семейство Phengodidae).Личинки и взрослые самки имеют на брюшных сегментах одиннадцать пар светящихся органов, испускающих зелёно-жёлтый свет (λmax = 535–565 нм), и светящийся орган на голове, испускающий красный свет (λmax = 600–620 нм) (Viviani. 1993). Исследования различных видов восьми родов Phengodidae, обитающих в Бразилии, показали, что их биолюминесцентная система использует люциферин светлячка (Viviani. 1993; Viviani. 1997).
Светящаяся личинка железнодорожного червя (семейство Phengodidae).Личинки и взрослые самки имеют на брюшных сегментах одиннадцать пар светящихся органов, испускающих зелёно-жёлтый свет (λmax = 535–565 нм), и светящийся орган на голове, испускающий красный свет (λmax = 600–620 нм) (Viviani. 1993). Исследования различных видов восьми родов Phengodidae, обитающих в Бразилии, показали, что их биолюминесцентная система использует люциферин светлячка (Viviani. 1993; Viviani. 1997).
Люциферазы железнодорожных червей (фенгодид)
Биолюминесцентная система железнодорожных червей является наименее изученной из всех, использующих светлячковый люциферин. Клонированы люциферазы всего из четырёх видов этих насекомых. Наиболее изученной является система Phrixothrix vivianii. Представители этого вида имеют по две разные люциферазы, значительно различающиеся по спектрам биолюминесценции катализируемых ими реакций. Одиннадцать дорсальных светящихся органов испускают жёлто-зелёный свет (λmax = 542 нм), а светящийся орган на голове даёт красную биолюминесценцию (λmax = 620 нм). Таким образом, железнодорожные черви обладают люциферазой с наиболее длинноволновым спектром биолюминесценции среди всех известных организмов (Viviani. 1993; Viviani. 1997; Viviani. 1999). В самой красной части спектра находится биолюминесценция Phrixotrix hirtus (λmax = 636 нм) (Viviani V. R. Nucleic acid molecules...).
Биохимические свойства люцифераз железнодорожных червей изучены относительно слабо. Однако точно известно, что, как и у жуков-щелкунов, люциферазы фенгодид не имеют батохромного сдвига при понижении рН реакционной смеси, характерного для люциферазы светлячков (Viviani. 1993; Viviani. 1995).
Применение
Использование люцифераз фенгодид для создания биолюминесцентных инструментов анализа остаётся достаточно ограниченным вследствие их недостаточной изученности, а также из-за их значительного биохимического сходства с люциферазами светлячков и жуков-щелкунов, на основе которых, напротив, создано большое количество методик для научных исследований. В то же время данная группа люцифераз имеет потенциал для применения, например, в качестве репортёров в биоимиджинге из-за их красного спектра биолюминесценции, который попадает в окно прозрачности биологических тканей (часть спектра, где наблюдается самое низкое поглощение света). Тем не менее на основе биолюминесцентной системы фенгодид был создан ряд инструментов для биоимиджинга и токсикологических исследований.