Плавление
Плавле́ние, переход вещества из твёрдого кристаллического состояния в жидкое; фазовый переход 1-го рода, сопровождающийся скачкообразным изменением объёма и энтропии вещества. При постоянном давлении плавление однокомпонентных веществ происходит при некоторой фиксированной температуре , называемой температурой плавления. Это свойство отличает кристаллические вещества от аморфных, переход которых в жидкое состояние идёт постепенно в некотором интервале температур. В результате плавления происходит позиционное разупорядочение системы: регулярное пространственное расположение атомов или молекул (дальний порядок) сменяется нерегулярным, причём средние расстояния между частицами изменяются незначительно. В ряде молекулярных кристаллов выделяют также другие механизмы разупорядочения при плавлении (ориентационный, конфигурационный, колебательный). Энтропия вещества при плавлении возрастает, причём в зависимости от характера изменения структуры вещества те или иные механизмы разупорядочения вносят различный вклад в её прирост. Например, для полупроводников, переходящих при плавлении в металлическое состояние, существенный вклад в энтропию обусловлен увеличением концентрации электронов проводимости при плавлении. Для разрыва связей между частицами при плавлении требуется энергия, величина которой зависит от конкретного вещества и называется теплотой плавления.
Температуры плавления разных веществ лежат в широком интервале. Среди однокомпонентных веществ наиболее низкую температуру плавления при атмосферном давлении имеет водород самым тугоплавким металлом является вольфрам а наиболее тугоплавкими соединениями – карбиды, например и
На фазовой диаграмме однокомпонентного вещества (рис. 1) зависимость от давления  Рис. 1. Фазовая диаграмма однокомпонентного вещества.(линия плавления) описывается линией соответствующей фазовому равновесию между кристаллом и жидкостью. Линия (продолжение линии плавления в область отрицательных давлений) описывает метастабильное состояние равновесия кристалла с жидкостью, находящихся в растянутом состоянии. Ход линии плавления определяется знаком изменения объёма. Для большинства веществ наблюдается увеличение объёма при плавлении и неограниченный рост при увеличении давления (нормальный ход линии плавления). Это означает более высокую упорядоченность и плотность кристаллической фазы по сравнению с расплавом. Вместе с тем известны вещества (например, галлий, висмут, лёд), у которых при относительно низких давлениях наблюдается уменьшение объёма при плавлении и уменьшение с ростом давления (аномальный ход линии плавления). При плавлении таких веществ происходит образование неупорядоченной структуры с более плотной упаковкой частиц. Однако с увеличением давления эти вещества испытывают полиморфный переход, после которого ход линии плавления становится нормальным. На линиях плавления некоторых веществ (например, цезия, бария) наблюдается температурный максимум, за которым (при повышении давления) ход линии плавления становится аномальным, причём в точке максимума кристалл и расплав имеют одинаковую плотность. При дальнейшем росте давления такие вещества испытывают полиморфный переход, после которого наклон кривых плавления вновь становится положительным.
Рис. 1. Фазовая диаграмма однокомпонентного вещества.(линия плавления) описывается линией соответствующей фазовому равновесию между кристаллом и жидкостью. Линия (продолжение линии плавления в область отрицательных давлений) описывает метастабильное состояние равновесия кристалла с жидкостью, находящихся в растянутом состоянии. Ход линии плавления определяется знаком изменения объёма. Для большинства веществ наблюдается увеличение объёма при плавлении и неограниченный рост при увеличении давления (нормальный ход линии плавления). Это означает более высокую упорядоченность и плотность кристаллической фазы по сравнению с расплавом. Вместе с тем известны вещества (например, галлий, висмут, лёд), у которых при относительно низких давлениях наблюдается уменьшение объёма при плавлении и уменьшение с ростом давления (аномальный ход линии плавления). При плавлении таких веществ происходит образование неупорядоченной структуры с более плотной упаковкой частиц. Однако с увеличением давления эти вещества испытывают полиморфный переход, после которого ход линии плавления становится нормальным. На линиях плавления некоторых веществ (например, цезия, бария) наблюдается температурный максимум, за которым (при повышении давления) ход линии плавления становится аномальным, причём в точке максимума кристалл и расплав имеют одинаковую плотность. При дальнейшем росте давления такие вещества испытывают полиморфный переход, после которого наклон кривых плавления вновь становится положительным.
На линии плавления (в отличие от линии равновесия жидкость – пар) отсутствуют особенности типа критической точки, что связано с различием симметрии кристалла и жидкости. Особый вид имеет фазовая диаграмма гелия: на ней отсутствует тройная точка равновесия кристалл – жидкость – пар. Твёрдый гелий может существовать только при повышенном давлении, которое при для составляет около 2,5 МПа, для – около 3,4 МПа.
При плавлении имеет место размерный эффект, который заметно проявляется в образцах субмикронного размера. В таких кристаллах большая доля атомов находится в поверхностном слое. Это приводит к тому, что переход от кристаллического состояния к жидкому, связанный с понижением энергии термодинамической системы, происходит при более низкой температуре, чем в массивных образцах. Например, если для макроскопического образца свинца то для образцов размером 10, 5 и 3 нм составляет соответственно
Для многокомпонентных систем зависит от их состава. Так, для двухкомпонентной системы с неограниченной растворимостью компонентов зависимость от концентрации x одного из них при постоянном давлении и одинаковой симметрии кристаллических решёток имеет вид, изображённый на рис. 2. Концентрации компонентов в кристалле и расплаве, находящихся в
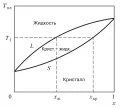 Рис. 2. Фазовая диаграмма двухкомпонентной системы.равновесии, различны ( и на рис. 2 при температуре ). Линии и на диаграмме описывают соответственно зависимости температуры начала (кривая солидуса) и температуры окончания (кривая ликвидуса) плавления от концентрации и ограничивают область, в которой сосуществуют кристаллы твёрдого раствора и расплав. Для случая ограниченной растворимости компонентов (с различной симметрией кристаллических решёток) фазовая диаграмма имеет более сложный вид.
Рис. 2. Фазовая диаграмма двухкомпонентной системы.равновесии, различны ( и на рис. 2 при температуре ). Линии и на диаграмме описывают соответственно зависимости температуры начала (кривая солидуса) и температуры окончания (кривая ликвидуса) плавления от концентрации и ограничивают область, в которой сосуществуют кристаллы твёрдого раствора и расплав. Для случая ограниченной растворимости компонентов (с различной симметрией кристаллических решёток) фазовая диаграмма имеет более сложный вид.
Плавление играет важную роль в природе и жизнедеятельности человека (плавление льда и снега, процессы в недрах Земли и космосе и др.). Плавление – составная часть многих технологических процессов (производство чистых металлов и сплавов, изделий из них).

