Биолюминесцентная система бактерий
Биолюминесце́нтная систе́ма бакте́рий, набор белков и небольших органических молекул, позволяющих некоторым представителям царства бактерий испускать свет. Ключевые компоненты системы: люциферин (миристиновый альдегид), флавинмононуклеотид (ФМН-Н2) и состоящий из двух субъединиц фермент люцифераза. В ряде случаев содержит дополнительные флуоресцентные белки. Идентифицированы ферменты, отвечающие за синтез люциферина. Биолюминесцентная система бактерий хорошо изучена, широко применяется в биотехнологии и медицинских исследованиях.
Светящиеся бактерии широко распространены в морской среде. Среди них обнаружены как свободноживущие, обитающие в морской воде, так и симбиотические виды, живущие в светящихся органах и других частях морских биолюминесцентных организмов. Биолюминесцентные бактерии являются причиной свечения мёртвых морских обитателей, остатков гниющей рыбы и мяса в природе и в антропогенной среде. Также они используются для испускания света некоторыми рыбами и беспозвоночными. Живущие в море светящиеся бактерии обычно относят к родам фотобактерий (Photobacterium), Beneckea и вибрионов (Vibrio), остальные – к родам Vibrio и Xenorhabdus.
История изучения
Способность бактерий излучать свет продемонстрирована Э. Н. Харви в первой половине 20 в. (Harvey. 1952). В результате дальнейших исследований установлено, что для биолюминесценции бактериям необходим ряд факторов: присутствие флавинмононуклеотида, растворимых алифатических альдегидов, люциферазы и кислорода (Cormier. 1953; Strehler. 1954), причём в данной реакции альдегид является люциферином (McElroy. 1955). Экспериментальные данные указывали на то, что в лабораторных условиях максимум эмиссии биолюминесценции лежит в пределах 472–505 нм (Seliger. 1968).
Гораздо позднее, в 1980-х гг., открыты, выделены и охарактеризованы жёлтые флуоресцентные белки (yellow fluorescent protein, YFP), сдвигающие максимум эмиссии биолюминесценции в длинноволновую область спектра (от 490 до 534 нм) благодаря механизму ферстеровского резонансного переноса энергии (förster resonance energy transfer, FRET) (Yellow light emission ...1987; Purification of the yellow fluorescent protein ... 1987; Petushkov. 1995). Также обнаружены синие флуоресцентные белки (lumazine proteins, LumP), сдвигающие максимум излучения биолюминесценции в коротковолновую область спектра (от 490 до 476 нм) со значительным увеличением яркости излучения (Koka. 1979; O’Kane. 1985).
В 1967 г. экспериментально показано, что люцифераза бактерий состоит из двух субъединиц: α-субъединицы массой около 40 кДа и β-субъединицы массой около 35 кДа (Friedland. 1967). Однако гены, кодирующие белки субъединиц, идентифицированы и клонированы только в конце 20 в. (Nucleotide sequence of the luxA gene ...1985; Johnston. 1986; Haygood. 1986).
Бактериальный люциферин – миристиновый альдегид
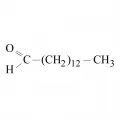 Структурная формула миристинового альдегида.Бактериальный люциферин – миристиновый альдегид – окисляется в процессе реакции, но не является истинным источником света, в этой роли выступает гидроксифлавин. Миристиновый альдегид является люциферином бактерий in vivo, однако in vitro реакция идёт и в присутствии некоторых других алифатических альдегидов (Ulitzur. 1979).
Структурная формула миристинового альдегида.Бактериальный люциферин – миристиновый альдегид – окисляется в процессе реакции, но не является истинным источником света, в этой роли выступает гидроксифлавин. Миристиновый альдегид является люциферином бактерий in vivo, однако in vitro реакция идёт и в присутствии некоторых других алифатических альдегидов (Ulitzur. 1979).
Люциферазы
Наиболее изучены биолюминесцентные системы бактерий Vibrio harveyi, Vibrio fischeri, Photorhabdus (Xenorhabdus) luminescens, Photobacterium phosphoreum и Photobacterium leiognathi. Все известные на момент написания статьи люциферазы бактерий имеют схожее строение: гетеродимерный комплекс, состоящий из двух субъединиц α и β (около 40 кДа и 35 кДа соответственно) (Friedland. 1967). Каждая субъединица люциферазы кодируется отдельным геном – luxA и luxB соответственно. Эти гены впервые были клонированы в конце 20 в. (Cohn. 1985; Johnston. 1986; Haygood. 1986). По отдельности субъединицы практически не обладают люциферазной активностью, поэтому простое смешивание растворов, каждый из которых содержит только одну субъединицу, активность не восстанавливает (Purified native subunits of bacterial luciferase ... 1993). Для её восстановления требуется совместная ренатурация рекомбинантных полипептидов обеих субъединиц (Contribution of folding steps ... 1993). Также было показано, что активный центр фермента, вероятнее всего, находится на α-субъединице (Cline. 1972).
Пространственная структура люциферазы Vibrio harveyi установлена в конце 20 в. (Three-dimensional structure ... 1995). Обе субъединицы имеют схожее строение, при этом α-субъединица способна связывать ФМН-Н2 (AbouKhair. 1985).
Люциферазы бактерий Photobacterium phosphoreum и Vibrio fischeri проявляют активность в диапазоне рН реакционной смеси от 6 до 8 (Nakamura. 1971; Hastings. 1978). Однако свойства люцифераз бактерий различаются в зависимости от того, из какого организма они клонированы. Например, люцифераза Vibrio fischeri стабильно работает при 30 °C, однако её активность падает практически до нуля при нагревании до 37 °C (Friedland. 1967). Люцифераза Vibrio harveyi, напротив, имеет температурный оптимум работы около 37 °C; люцифераза из Photobacterium luminescens остаётся стабильной вплоть до 42 °C (Szittner. 1990).
Главное достоинство биолюминесцентной системы бактерий по сравнению со всеми другими известными системами – возможность полностью закодировать её с помощью lux оперона. Оперон luxCDABE кодирует люциферазу (luxA и luxB) и белки (редуктазу, трансферазу и синтетазу), необходимые для синтеза субстрата (luxCDE) (Biotechnological improvements of bioluminescent systems. 2010).
Люциферин-люциферазная реакция
Многие научные коллективы изучали механизм люминесцентной реакции бактерий, и в результате, на основе экспериментальных данных, предложена следующая схема реакции (Shimomura. 2006):
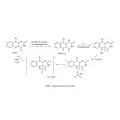 Механизм бактериальной биолюминесценции.
Механизм бактериальной биолюминесценции.
Применение
В основном биолюминесцентная система бактерий используется для создания биосенсоров (как ген-репортёр), исследования развития бактериальных заболеваний и экотоксических исследований. Созданы биосенсоры для обнаружения в воде и почве различных молекул загрязнителей как органического, так и неорганического происхождения; системы мониторинга различных метаболитов, применяемые в исследованиях по изучению раковых опухолей; модельные системы на основе бактериальных биолюминесцентных систем для исследований взаимодействия патоген/хозяин и развития инфекции ран, ожогов, зубов и мягких тканей, а также для изучения инфекций, вызванных бактериями, вирусами, грибами и простейшими.
