Лактальбумин
Лактальбуми́н (α-лактальбумин) (от лат. lac, род. падеж lactis – молоко и albumen, род. падеж albuminis – белок), белок из группы альбуминов (простых водорастворимых глобулярных белков), входящий в состав молочной сыворотки.
Лактальбумин содержится в молоке многих млекопитающих. Так, в коровьем молоке на белок казеин приходится 80 %, а на молочную сыворотку – 20 % от общего объёма. Сыворотка же состоит на 25 % из α-лактальбумина (что составляет примерно 5 % от всех белков коровьего молока).
Лактальбумин – видоспецифичный белок. Это значит, что молоко других животных при сенсибилизации к лактальбумину не будет вызывать аллергию.
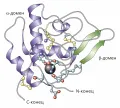
α-Лактальбумин – кальцийсвязывающий белок весом 14,2 кДа из семейства гидролаз. Состоит из двух доменов: α и β, которые соединяются дисульфидными мостиками. Кальций стабилизирует трёхмерную структуру белка и тем самым делает его более стойким к воздействию денатурирующих агентов и к нагреванию.
α-Лактальбумин имеет несколько трёхмерных (конформационных) эпитопов, с помощью которых он связывается с иммуноглобулинами Е (IgE), что и делает его потенциальным аллергеном. Аллергенность частично сохраняется даже после денатурации, т. к. у белка появляются другие, линейные эпитопы, также способные связывать IgE. Однако после 15–20 мин кипячения люди, чувствительные к этому белку, могут пить молоко, не опасаясь аллергической реакции.
α-Лактальбумин входит в состав грудного молока приматов (в том числе и человека) и кодируется геном LALBA. Экспрессия этого гена повышается под действием гормона пролактина. Лактальбумин является частью фермента синтетазы лактозы, поэтому в результате усиливается выработка лактозы.
Способность α-лактальбумина связывать ионы кальция, а также цинка объясняет его противоопухолевую и бактерицидную активность. Так, пептидный комплекс HAMLET (human alpha-lactalbumin made lethal to tumor cells – комплекс α-лактальбумина и олеиновой кислоты), образующийся в результате фолдинга, запускает процесс апоптоза в опухолевых и недифференцированных клетках.
Кроме того, ген, кодирующий α-лактальбумин, очень похож на ген фермента лизоцима, обладающего антибактериальными свойствами. Предполагается, что ген α-лактальбумина образовался в результате дупликации ранней версии гена лизоцима примерно 300 млн лет назад у общего предка птиц и млекопитающих.