Эксцизионная репарация нуклеотидов
Эксцизио́нная репара́ция нуклеоти́дов (ЭРН), совокупность репаративных процессов, устраняющих объёмные искажения структуры молекулы ДНК за счёт удаления олигонуклеотидного участка цепи и синтеза удалённого фрагмента.
История открытия и изучения
В 1964 г. сначала у бактерий, затем и у человека обнаружена эксцизионная репарация нуклеотидов. В бактериях, подвергшихся УФ-облучению, осуществляется удаление фрагментов ДНК, содержащих пиримидиновые димеры. В 1968 г. выявлена связь дефектов работы ЭРН и развития пигментной ксеродермы. Активные исследования в 1980–1990-х гг. привели к клонированию и биохимическому описанию многих генов, кодирующих ферменты ЭРН.
Механизмы эксцизионной репарации нуклеотидов
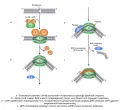
Ферменты системы ЭРН узнают не само повреждённое основание, а искажение структуры двойной спирали ДНК, вызванное объёмными интеркалирующими агентами или продуктами фотодимеризации пиримидинов. Первым этапом процесса восстановления структуры ДНК является удаление короткого олигонуклеотидного участка, содержащего повреждение. Затем по матрице неповреждённой цепи происходит синтез и встраивание заплатки (патча, patch), которая может включать в себя от 1 до 10 нуклеотидов.
У прокариот в процессе ЭРН участвуют 4 фермента: UvrA, UvrB, UvrC и UvrD (от ultraviolet radiation – ультрафиолетовое излучение). Первые 2 белка функционируют в виде комплекса, состоящего из 2 единиц каждого из белков. Белок UvrA распознаёт искажения структуры, после чего покидает комплекс. UvrB, разрывая водородные связи между парами комплементарных оснований, индуцирует расхождение цепей ДНК в месте повреждения. Белок UvrC благодаря своей эндонуклеазной активности вносит разрезы (инцизии) с 5’- и 3’-стороны от повреждённого основания, а хеликаза UvrD удаляет вырезанный участок. Процесс репарации завершается синтезом новой цепи и сшивкой концов с помощью ДНК-полимеразы I и ДНК-лигазы.
У эукариот система ЭРН устроена гораздо сложнее и включает в себя более 25 белков, самые важные из которых: комплекс XPC/Rad23B, соответствующий белку UvrA у прокариот, распознающий искажение структуры (в случае циклобутановых пиримидиновых димеров – DDB1/2); белки XPA, XPD и RPA – функциональные аналоги UvrB; белковые комплексы ERCC1/XPF и XPG, которые обладают эндонуклеазной активностью по отношению к 5’-концу и 3’-концу, соответственно. Отсутствующий фрагмент восстанавливают эукариотические репликативные белки.
Процесс репарации может сопутствовать процессу транскрипции, т. к. РНК-полимеразы чувствительны к искажениям структуры ДНК и могут инициировать запуск системы ЭРН. При достижении повреждённого участка РНК-полимераза не может продвигаться дальше, и транскрипция останавливается. Для того чтобы фермент мог продолжить свою работу в клетке существует механизм запуска ЭРН, сопряжённый с транскрипцией (transcription-coupled nucleotide excision repair, TC-NER).
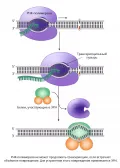 Сопряжённая с транскрипцией репарация.У прокариот связь процессов транскрипции и репарации происходит при участии ферментов TRCF (transcriptional-repair coupling factor), или Mfd, которые осуществляют вытеснение остановленной повреждением РНК-полимеразы и вовлекают репаративный комплекс ферментов в работу.
Сопряжённая с транскрипцией репарация.У прокариот связь процессов транскрипции и репарации происходит при участии ферментов TRCF (transcriptional-repair coupling factor), или Mfd, которые осуществляют вытеснение остановленной повреждением РНК-полимеразы и вовлекают репаративный комплекс ферментов в работу.
Ключевую роль в совмещении двух процессов транскрипции и репарации у эукариот играет фактор транскрипции TFIIH (transcription factor II Human), который обладает хеликазной активностью, так как в его состав входят субъединицы XPA и XPD.
У прокариот после устранения повреждения ДНК ген транскрибируется заново, а не прошедшая транскрипцию молекула РНК разрушается под действием рибонуклеаз. У эукариот гены имеют гораздо большую протяжённость и повреждение останавливает работу РНК-полимеразы II, а система репарации запускает её после устранения повреждения с того же места. Механизм возобновления работы РНК-полимеразы II требует дальнейшего изучения.