Сопряжение связей
Сопряже́ние свя́зей (конъюгация связей), чередование простых и кратных связей в структурной формуле соединений, сопровождающееся взаимодействием кратных связей через разделяющую их простую связь. Термин «сопряжение связей» был предложен в 1899 г. немецким химиком Иоганнесом Тиле.
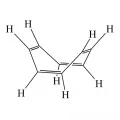
 π,π-сопряжение связей в бутадиене-1,3 СН₂=СН–СН=СН₂.Альтернирование простых и кратных связей само по себе не гарантирует их сопряжения. В циклооктатетраене I смежные альтернирующие двойные связи не являются компланарными, не взаимодействуют друг с другом, и потому сопряжение связей в системе отсутствует. Из-за отсутствия дальнодействующих взаимодействий циклооктатетраен приобретает неплоскую конформацию, неароматичен и ведёт себя как циклоалкен.
π,π-сопряжение связей в бутадиене-1,3 СН₂=СН–СН=СН₂.Альтернирование простых и кратных связей само по себе не гарантирует их сопряжения. В циклооктатетраене I смежные альтернирующие двойные связи не являются компланарными, не взаимодействуют друг с другом, и потому сопряжение связей в системе отсутствует. Из-за отсутствия дальнодействующих взаимодействий циклооктатетраен приобретает неплоскую конформацию, неароматичен и ведёт себя как циклоалкен.
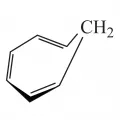
 Структурная формула циклооктатетраена.В широком смысле понятие «сопряжение связей» охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных связей включается один или большее число sp3-гибридизованных атомов, например соединение циклооктатетраен), спиросопряжение (в ненасыщенных спирановых структурах, гомобензол), сверхсопряжение (гиперконъюгация) – сопряжение кратных (или группы простых) связей с группой σ-связей одного атомного центра (например спиро[2,4]гепта-1,4,6-триен и толуол).
Структурная формула циклооктатетраена.В широком смысле понятие «сопряжение связей» охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных связей включается один или большее число sp3-гибридизованных атомов, например соединение циклооктатетраен), спиросопряжение (в ненасыщенных спирановых структурах, гомобензол), сверхсопряжение (гиперконъюгация) – сопряжение кратных (или группы простых) связей с группой σ-связей одного атомного центра (например спиро[2,4]гепта-1,4,6-триен и толуол).
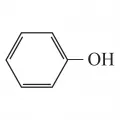
Расширение толкования сопряжения связей связано также с представлениями о сопряжении не только нескольких связей, но и кратных (или простых) связей с любым атомным центром – как обладающим одним электроном или неподелённой электронной парой (С–, О, NR2 и др., например фенол), так и центром с вакантной орбиталью (C+, B, Аl и др., например катионы I и II). Структурная единица, содержащая сопряжённые связи, называется сопряжённой системой.
В молекуле фенола на атоме кислорода имеются две неподелённые электронные пары; в катионах I и II в сопряжении участвуют атомы углерода C+ с вакантной p-орбиталью.
Квантовая химия рассматривает сопряжение связей как взаимодействие между орбиталями отдельных фрагментов молекулы, которое может осуществляться по тому или иному механизму. Например, σ-сопряжению соответствует взаимодействие орбиталей простых связей, π-сопряжению – взаимодействие орбиталей кратных связей. σ-сопряжение связей присутствует в любой молекуле, состоящей из трёх или большего числа атомов. В то же время наблюдаемые свойства полиенов и аннуленов описываются исходя из представлений как σ-, так и π-сопряжения.
Сопряжение связей не обязательно означает неприменимость модели локализованных связей к рассматриваемой молекуле. Электронная заселённость локализованных молярных орбиталей вне σ-связей не превышает 1 %. Так же хорошо локализованы и π-связи в сопряжённых неароматических системах (особенно когда учитывается альтернирование связей): например, в линейных полиенах заселённость вне двухцентровых связей около 2 %. Такие сопряжённые системы описываются одной резонансной структурой со связями только между соседними атомами и без разделения формальных зарядов, а их коллективные свойства удаётся рассматривать в рамках аддитивных моделей.
В то же время в ароматических и некоторых других системах, которые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных молярных орбиталей имеют большие веса́ вне связей (например, в бензоле около 13 %), сопряжение связей обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные свойства таких сопряжённых систем в принципе нельзя представить в виде аддитивных функций свойств связей.
 Сопряжение связей в бензоле C₆H₆.Наиболее существенной особенностью сопряжённых систем с делокализованными связями является их повышенная термодинамическая устойчивость. В ароматических системах тепло́ты образования значительно выше, чем значения, найденные с учётом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин. Количественная мера повышения термодинамической устойчивости таких систем – энергия резонанса (сопряжения, делокализации). В сопряжённых системах правилам аддитивности не подчиняются также параметры ИК-спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчёте различных характеристик вводят поправочные члены экзальтации и т. п.
Сопряжение связей в бензоле C₆H₆.Наиболее существенной особенностью сопряжённых систем с делокализованными связями является их повышенная термодинамическая устойчивость. В ароматических системах тепло́ты образования значительно выше, чем значения, найденные с учётом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин. Количественная мера повышения термодинамической устойчивости таких систем – энергия резонанса (сопряжения, делокализации). В сопряжённых системах правилам аддитивности не подчиняются также параметры ИК-спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчёте различных характеристик вводят поправочные члены экзальтации и т. п.
Наличием сопряжения связей объясняют характерное изменение геометрии молекулы – укорочение формально простых и удлинение формально кратных связей. Например, в полиенах длины простых связей C–C (0,151 нм) несколько укорочены по сравнению с длиной связи C–C в этане (0,154 нм). Количественная мера изменения длин связей при сопряжении – порядки связей между атомами: в 1,3-бутадиене порядки связей альтернируют (соответственно 1,894; 1,447; 1,894), а в аллильном катионе порядки связей между соседними атомами C равны.
Сопряжённые системы с делокализованными связями представляют собой соединения с характеристическими электронными переходами, причём с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону бо́льших длин волн (соответственно гиперхромный эффект и батохромный сдвиг; см. Цветность органических соединений). С добавлением каждой двойной связи сопряжённая система поглощает фотоны с меньшей энергией и цвет соединения варьируется от жёлтого до красного.
Понятие «сопряжение связей» используют при рассмотрении реакционной способности. Например, электрофильное присоединение к сопряжённым диенам приводит к смеси продуктов 1,2- и 1,4-присоединения.