Уравнение Аррениуса
Уравне́ние Арре́ниуса, описывает зависимость константы скорости химической реакции от температуры в виде: , где – предэкспоненциальный множитель, – энергия активации, – газовая постоянная, – абсолютная температура. Предложено С. Аррениусом в 1889 г. Множитель для простой реакции представляет собой долю молекул с энергией, достаточной, чтобы произошла реакция. График зависимости от – прямая линия: численные значения и определяют по значению начальной ординаты и тангенса угла наклона этой прямой.
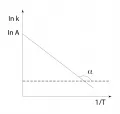 График зависимости lnk от 1/Т.Множитель изменяется в диапазоне 1013–1015 с–1 для мономолекулярных и 106–1010 дм3·моль–1·с–1 для бимолекулярных реакций. Энергия активации большинства реакций составляет величину 10–100 кДж/моль. Для сложных реакций определяемая – эффективная величина, которая является функцией энергий активаций отдельных стадий, зависит от температуры, может принимать отрицательные значения. В широком интервале температур бимолекулярные реакции лучше описываются уравнением: . В некоторых случаях, например для быстрых реакций, реакций в вязких средах, реакций с туннельным эффектом, уравнение Аррениуса неприменимо.
График зависимости lnk от 1/Т.Множитель изменяется в диапазоне 1013–1015 с–1 для мономолекулярных и 106–1010 дм3·моль–1·с–1 для бимолекулярных реакций. Энергия активации большинства реакций составляет величину 10–100 кДж/моль. Для сложных реакций определяемая – эффективная величина, которая является функцией энергий активаций отдельных стадий, зависит от температуры, может принимать отрицательные значения. В широком интервале температур бимолекулярные реакции лучше описываются уравнением: . В некоторых случаях, например для быстрых реакций, реакций в вязких средах, реакций с туннельным эффектом, уравнение Аррениуса неприменимо.
